Քիմիական կապի առաջացման հիմնական շարժիչ ուժն ատոմի՝ 8 էլեկտրոն պարունակող արտաքին էներգիական մակարդակ ունենալու ձգտումն է:
Քննարկենք, թե ինչպես կարող է քիմիական կապ առաջանալ էլեկտրաբացասականությամբ միմյանցից կտրուկ տարբերվող ատոմների միջև, օրինակ` նատրիումի (Na) և ֆտորի(F):
Նատրիումի ատոմն իր արտաքին շերտի մեկ էլեկտրոնը տրամադրում է ֆտորի ատոմին և փոխարկվում է ութ էլեկտրոն պարունակող, կայուն, դրական լիցքավորված մասնիկի, այսինքն` ստացվում է նեոն (Ne) իներտ գազի էլեկտրոնային կառուցվածք.
Na0−e−→Na+
Ֆտորի ատոմն արտաքին էլեկտրոնային շերտում յոթ էլեկտրոն ունի, և կայուն վիճակի համար ֆտորի ատոմին ընդամենը մեկ էլեկտրոն է պակասում, ուստիև ավարտուն արտաքին էներգիական մակարդակ ստանալու համար շատ ավելի հեշտ է այդ ատոմին մեկ էլեկտրոն միացնել: Այդ մեկ էլեկտրոնը նատրիումի ատոմից վերցնելիս ֆտորի ատոմը փոխարկվում է 8 էլեկտրոն պարունակող, կայուն արտաքին շերտով, բացասական լիցքավորված մասնիկի այսինքն, ստացվում է նեոն (Ne) իներտ գազի էլեկտրոնային կառուցվածք.
F0+e−→F−
Դրական (Na+) և բացասական F− մասնիկների միջև էլեկտրաստատիկական ձգողության ուժեր են ծագում, և որպես արդյունք՝ առաջանում է նատրիումի ֆտորիդ նյութը:
Իոնները լիցքավորված մասնիկներ են, որոնք առաջանում են չեզոք ատոմներին էլեկտրոն միանալիս կամ էլեկտրոն տրամադրելիս:
Իոնի ձեռք բերած էլեկտրական լիցքն անվանվում է իոնի լիցք:
Իոնի լիցքը նշելիս նրա թվային արժեքը գրվում է «+» կամ «−» նշանով, ընդ որում՝ միալիցք իոնների դեպքում 1 թիվը չի գրվում:
Այն քիմիական կապը, որն առաջանում է իոնների միջև գործող էլեկտրաստատիկական փոխազդեցության շնորհիվ անվանվում է իոնային:
Էլեկտրաստատիկական ուժերի ծագման հետևանքով ձևավորվում է այսպես կոչված իոնային բյուրեղավանդակը:
Իոնային բյուրեղավանդակ առաջացրած միացություններն էլ անվանվում են իոնային միացություններ:
Օրինակ
NaF, NaCl, MgBr2, CaCl2
Իոնային կապ են առաջացնում նաև բարդ իոնները՝ լիցքավորված բազմատոմ մասնիկները, օրինակ՝(NH4)+ ,(SO4)2−(OH),−(NO3)− և այլն:
Դրանք նույնպես իոնային կապով են միանում տարանուն լիցքով ոններին՝ (NH4)+Br−+,(SO4)+Ca2+,K++(OH)− և այլն:
Այս դեպքում բյուրեղավանդակի հանգույցներում կանոնավոր դասավորվում են պարզ և բարդ իոնները:
Իոնային կապը հագեցած չէ:Իոնային կապն ուղղորդված չէ:
Սրանք են իոնային կապի գլխավոր հատկությունները: Այս կապի ուղղորդված չլինելը բացատրվում է այն հանգամանքով, որ լիցքի գնդաձև էլեկտրաստատիկական դաշտն իոնի շուրջը բոլոր ուղղություններով համաչափ է, և տարանուն լիցքով իոնը կարող է տարբեր կողմերից ձգվել, ընդ որում՝ կարող են տարբեր թվերով իոններ ձգվել: Այլ կերպ ասած՝ իոնային կապն առաջանում է ոչ թե տեղայնացված երկու մասնիկի, այլ մեծաթիվ մասնիկների միջև ու տարածական տարբեր ուղղություններով:
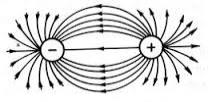
Իսկ տարբեր ուղղություններով գործող փոխազդեցության ուժերի գոյությունն ապացույց է, որ իոնային կապը հագեցած չէ: Այսպես, նատրիումի քլորիդի (NaCl) բյուրեղներում նատրիումի յուրաքանչյուր իոն (Na+) շրջապատված է քլորի 6 իոնով, քլորի յուրաքանչյուր իոն (Cl)՝ նատրիումի 6 իոնով:
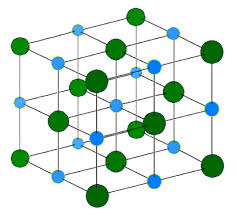
Իոնային միացությունների բյուրեղավանդակները կայուն են, ուստիև բնորոշվում են հալման ու եռման բարձր ջերմաստիճաններով:
